SARS-CoV-2 Vaccination and the Multi-Hit Hypothesis of Oncogenesis - mectin iver (?)
2024/06/29 (Sat) 15:37:41
 DESさんへ
DESさんへ
冒頭の一部を引用しましたが論文のリンクを見た方が見やすいです。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10792266/
レビュー
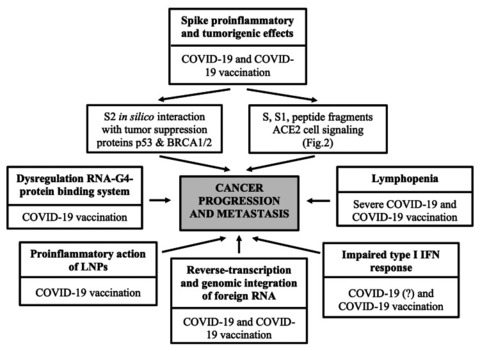
SARS-CoV-2 スパイク糖タンパク質ベースのワクチン、特に mRNA ワクチンは、がんの進行や DCC の再活性化に有利な (一時的な) 腫瘍形成促進環境を総合的に生成する可能性のある一連の生物学的メカニズムを開始する可能性があります。これらの副作用は、脂質ナノ粒子 (LNP) の炎症促進作用、I 型インターフェロン (IFN) 応答の障害、構造的に修飾された mRNA によって引き起こされる細胞マイクロ RNA の翻訳調節異常 (mRNA ワクチン)、および/または生成された抗原、つまり SARS-CoV-2 スパイクタンパク質および/またはそのサブユニット S1 と S2 (mRNA およびアデノウイルスベクター化ワクチン) の独特の性質、発現パターン、結合プロファイル、および炎症促進および腫瘍形成効果に起因する可能性があります (図(図1)。
さらに、ワクチン接種者の血液中に可溶性スパイクやそのサブユニット、ペプチド断片が大量に存在し、数週間から数か月間も体内に留まることが確認されています。そのため、人体内でのスパイクの持続的かつ全身的な分布(ウイルススパイクはほとんどの場合、呼吸器系以外の組織や臓器には影響を及ぼしません)が、可溶性の循環型またはさまざまな組織や臓器の細胞で発現しているSARS-CoV-2の侵入受容体であるアンジオテンシン変換酵素2(ACE2)とのさまざまな予期せぬ相互作用を促進する可能性があります。
以上の理由から、COVID-19 と COVID-19 ワクチン接種が癌細胞とその微小環境に及ぼす影響を理解することが不可欠です。
Re: SARS-CoV-2 Vaccination and the Multi-Hit Hypothesis of Oncogenesis - mectin iver (?)
2024/06/29 (Sat) 15:54:30
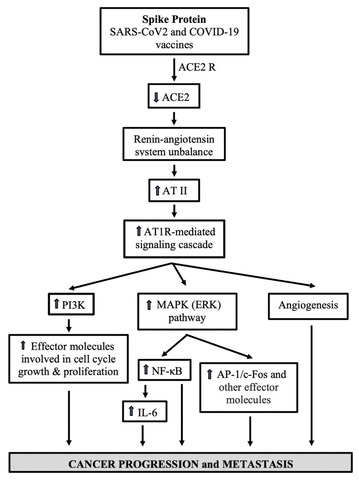 SARS-CoV-2スパイク糖タンパク質とそのS1サブユニットは、in vitroで細胞シグナル伝達を引き起こし、in vivoで腫瘍形成につながる可能性がある。
SARS-CoV-2スパイク糖タンパク質とそのS1サブユニットは、in vitroで細胞シグナル伝達を引き起こし、in vivoで腫瘍形成につながる可能性がある。
SARS-CoV-2には、S1とS2という2つのサブユニットからなるスパイクタンパク質が含まれています。S1は、多くの細胞の表面に主に発現している多機能タンパク質であるACE2に結合して、ウイルスがヒト細胞に感染するのを助けます[ 60、61]。S2は膜融合プロセスを媒介します[62 ]。SARS - CoV-2の宿主細胞への侵入を促進することに加えて、スパイクとAEC2の相互作用は、ACE2を発現している細胞で細胞シグナル伝達を誘発します[ 63 ]。データによると、肺血管細胞と肺動脈性高血圧症の発症に関与する細胞では、スパイクのS1サブユニットのみが、細胞増殖のシグナル伝達機構である細胞外シグナル制御キナーゼ(ERK)の調節因子であるMEKを活性化しました[ 63 ]。さらに、Patra et al. [ 65 ]は、全長スパイクがACE2発現のダウンレギュレーションを介してアンジオテンシンIIタイプI受容体(AT1R)を介したシグナル伝達カスケードを促進し、ミトゲン活性化タンパク質キナーゼ(MAPK)活性化を介して転写調節分子核因子κB(NF-κB)および活性化タンパク質1(AP-1)/c-Fosを誘導し、上皮細胞中のインターロイキン6(IL-6)レベルを上昇させたことを伝えた(図(図2)2)[ 65 ]。
Re: SARS-CoV-2 Vaccination and the Multi-Hit Hypothesis of Oncogenesis - mectin iver (?)
2024/06/29 (Sat) 15:55:40
がん細胞におけるNF-κBの活性化は増殖、化学療法抵抗性、浸潤を促進する一方、腫瘍微小環境では血管新生と免疫抑制を刺激し、転移プロセスを総合的にサポートする[ 66 ]。Ras/Raf/MEK/ERK(MAPK)シグナル伝達カスケードは悪性腫瘍に頻繁に関与している[ 67 ]。実際、ヒトのがんの30%以上がRas遺伝子によって引き起こされている[ 68-75 ]。IL-6レベルの上昇は、乳がんと頭頸部がんの腫瘍再発率の上昇と相関している[ 76,77 ]。対照的に、IL-6/シグナル伝達および転写活性化因子3( STAT3 )シグナル伝達の阻害は、乳がん、頭頸部がん、肝細胞がんの前臨床モデルにおいてがんの再発を減少させた[ 78-80 ] 。 AT1Rを介したシグナル伝達カスケードは、最も重要な細胞内経路(PI3K/AKT/mTOR)の1つであり、癌のマスターレギュレーターであるホスファチジルイノシトール3キナーゼ(PI3K)も活性化します[ 67、81 ]。この経路の過剰活性化は多くのヒト悪性腫瘍に存在し、癌の進行に関与していることが示唆されています。一貫して、PIK3阻害剤の使用は腫瘍の治療における一般的なアプローチです[ 82 ]。
ヒト細胞がスパイクやそのS1サブユニットに敏感に反応してACE2細胞シグナル伝達を誘発し、ACE2が癌の血管新生や転移の阻害を含む複数の抗腫瘍効果と抗浸潤効果を発揮することを考慮すると、長期にわたる(または一時的でさえある)スパイク媒介ACE2ダウンレギュレーション(または喪失)は、それ自体が腫瘍の進行を促進する可能性がある[ 83-86 ]。驚くべきことに、自由に浮遊するスパイク、Sサブユニット、およびSペプチド断片は、COVID-19ワクチン接種後、重症COVID-19患者で見られる濃度と同等の濃度で、数週間[ 87、88 ]、さらには数ヶ月[ 89 ]も循環に入り、体内に残留することが判明している(表(表1)1)[ 89,90 ]。